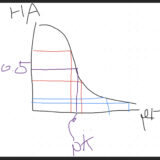
Henderson–Hasselbalch equationにより、
pH=pK+log([A]/[HA])
また、体内ではAはHCO3–、HAは血中H2CO3の濃度、ようするに炭酸の溶解度×血中CO2濃度で表せる。
よって上の式はこのように書き換えられる。
pH=pK+log([HCO3-]/0.03×PCO2)
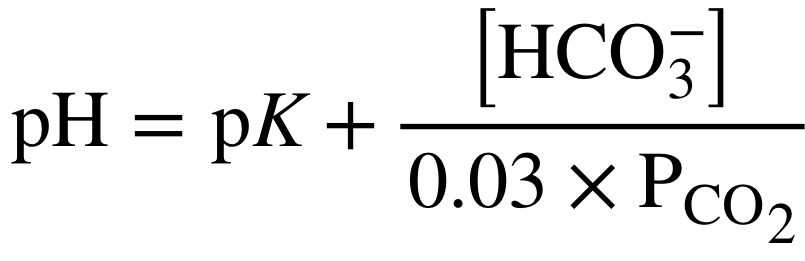
この式はめちゃくちゃ大事!!!
代謝性アシドーシスから呼吸性代償の過呼吸が起きる流れ
以下、代謝性アシドーシスから呼吸性代償の過呼吸が起きる機序を説明する。
- 代謝性アシドーシスでは体内に不揮発性のH⁺が多くなる。
- そして細胞内外の緩衝効果が起こる。
- 細胞外ではHCO₃⁻によって緩衝されるので、細胞外[HCO₃⁻]の低下が起こる。
- これにより、Hendersonの式からpHが低下する。
- よって、ホメオスタシスを維持するために(pHを一定に保つために)PCO2を下げる向きに呼吸性代償が動く。
- 過呼吸を行う。
呼吸性アルカローシスと腎性代償
Hendersonの式を見ながら考える。
- 過呼吸になると血中CO2濃度が減少する。
- これとHendersonの式をみると、pHが増加、つまりアルカローシスになることがわかる。
- pHを一定に保つために、HCO₃⁻を減らそうとする。
- 腎臓においてHCO₃⁻の再吸収を抑制する。